La peste, une maladie ré-émergente à Madagascar
Suzanne Chanteau,* Lala Ratsifasoamanana,† Bruno Rasoamanana,*† Lila Rahalison,* Jean Randriambelosoa,† Jean Roux,* and Dieudonné Rabeson†
*Institut Pasteur, Antananarivo, Madagascar; and †Ministère Santé, Antananarivo, Madagascar
Des cas de peste chez l’homme, qui avait pratiquement disparue à Madagascar depuis les années 1930, sont ré-apparus en 1990 avec plus de 200 cas confirmés ou présumés rapportés chaque année depuis cette date. La peste a été réintroduite, et des épidémies surviennent chaque année dans le port de Mahajanga. Dans la capitale, Antananarivo, le nombre de cas a augmenté, et de nombreux rongeurs sont infectés avec Yersinia pestis. En dépit de la surveillance de la sensibilité de Y. pestis et des puces aux médicaments et insecticides, et des mesures de contrôle pour prévenir la propagation de cas sporadiques, l’élimination de la peste a été difficile car l’hôte et réservoir du bacille, Rattus rattus, est un rat domestique et sauvage.
Au cours des 15 dernières années, Madagascar (13 millions d’habitants) a enregistré 45 % des cas de peste en Afrique (1).
Epidémiologie
Plague was brought to the island of Madagascar in 1898 by steamboats from India and has never disappeared. As a result of vaccination campaigns, improved housing and public hygiene, and the discovery of streptomycin and insecticides, plague was controlled in the 1950s. During the next 30 years, only 20 to 50 cases per year were reported in the entire country. However, since 1989, the number of suspected cases has increased steadily (Figure 1). Since 1990, 800 to 1,500 cases of suspected plague have been reported, of which 150 to 230 were smear-positive (presumptive cases) or confirmed by the isolation of Y. pestis (2,3). The population exposed to plague in the plateaus is approximately 5 million; the mean annual rate of known human cases (except in Mahajanga) is 3 to 4 per 100,000 inhabitants. The mean annual death rate is 20% of the confirmed or presumptive cases. Bubonic plague is the main clinical form of the disease (approximately 95% of cases).
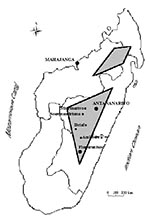
With the exception of the west coast port of Mahajanga, plague is endemic in areas more than 800 m high. The major focus area is a central triangle, and the minor focus is a northern diamond (Figure 2). The main plague foci (in order of importance) are Mahajanga, the district of Ambositra, the town of Antananarivo, and the districts of Fianarantsoa II, Miarinarivo, Betafo, and Soavinandriana. In the plateaus, the human plague season is September to April, while in Mahajanga it is July to November.
La peste a été introduite sur l’île de Madagascar en 1898 par les navires à vapeur en provenance de l’Inde. Depuis elle n’a jamais été éradiquée. A la suite de campagnes de vaccination, de l’amélioration de l’habitat et des conditions d’hygiène publique, de la découverte de la streptomycine et des insecticides, la peste a été contrôlée dans les années 1950. Au cours des 30 années suivantes, seulement 20 à 50 cas annuels ont été rapportés pour tout le pays. Depuis 1990, le nombre de cas suspects déclarés a augmenté de façon constante (Figure 1): sur les 800 à 1 500 malades suspects notifiés chaque année, 150 à 230 cas sont présumés pesteux (frottis positif à la microscopie) ou confirmés (Y. pestis isolé (2,3). La population des hauts plateaux exposée à la peste est d’environ 5 millions ; le taux d’incidence annuel moyen (à l’exception de Mahajanga) est de 3 à 4 pour 100 000 habitants. Le taux de létalité annuel moyen rapporté sur les cas confirmés ou probables est de 20%. La peste bubonique est la principale forme clinique rencontrée (environ 95 % des cas).
A l’exception du port de Mahajanga sur la côte ouest, la peste est endémique sur les plateaux situés à plus de 800 mètres d’altitude, formant un triangle central très actif et un losange d’activité mineure au nord de l’île (Figure 2). Les principaux foyers par ordre d’importance sont le port de Mahajanga, le district d’Ambositra, la ville d’Antananarivo et les districts de Fianarantsoa II, Miarinarivo, Betafo, et Soavinandriana. La saison pesteuse humaine s’étend de septembre à avril sur les hautes terres, et de juillet à novembre à Mahajanga.
En 1996, sur les 1 644 cas suspects rapportés 1 316 avaient été prélevés pour des analyses bactériologiques. Parmi ceux là, 173 cas confirmés et 56 cas probables ont été officiellement déclarés à l’OMS. De Janvier à Octobre 1997, déjà 2 127 cas suspects ont été rapportés (soit plus de 2 500 cas attendus pour l’année) dont 260 cas confirmés et 33 probables. Le nombre de cas de peste confirmés ou probables est probablement sous-estimé, en raison de la sous déclaration des malades dans les zones éloignées et du manque de sensibilité des techniques bactériologiques utilisées pour le diagnostic. Les résultats préliminaires obtenus avec des tests immunodiagnostiques, tels que la détection des anticorps anti-F1 (4) et de l’antigène F1 (tests fournis par le Naval Medical Research Institute, Bethesda, MD), donne une estimation du nombre de malades compris entre deux et trois fois celui obtenus par les méthodes classiques (S. Chanteau et J. Burans, unpub. data). Il est impossible de savoir si l’augmentation significative des cas entre 1996 et 1997 est due à une amélioration du système de surveillance (meilleure déclaration suite aux campagnes d’éducation sanitaire), ou à une réelle augmentation de l’incidence de la maladie.
A Madagascar, le réservoir de Y. pestis est constitué par deux espèces de rats, Rattus rattus (réservoir principal) et R norvegicus (réservoir secondaire). L’existence d’un réservoir sauvage possible reste à démontrer. R. norvegicus, rat commensal vivant en milieu urbain et introduit à Madagascar au début du 20ème siècle, ne se rencontre actuellement que dans les villes côtières et à Antananarivo où il est largement majoritaire par rapport à R. rattus. En revanche, R. rattus, probablement importé à Madagascar au cours des premières migrations humaines, s’est bien adapté et a envahi tous les écosystèmes de l’île, devenant ainsi un rongeur domestique et sauvage à la fois. Généralement c’est l’unique espèce de rongeur rencontrée dans les petites villes, les villages, les champs de riz et les prairies. Ainsi contrairement aux observations faites dans d’autres pays où les espèces impliquées dans les épizooties sont différentes des espèces réservoirs de Y. pestis , à Madagascar les réservoirs sont les mêmes espèces ayant survécu à l’infection. Par conséquent, il est quasiment impossible d’éradiquer la peste de l’île.
Les vecteurs de la peste à Madagascar sont deux espèces de puces de rats : Xenopsylla cheopis étant la puce universelle asiatique très efficace et la puce endémique Synopsyllus fonquernieri (2). Elles sont toutes deux présentes chez R. rattus, bien que X. cheopis ne parasite que les rongeurs vivant en milieu urbain ou à l’intérieur des maisons, alors que S. fonquernieri est retrouvé sur les rongeurs en milieu extérieur et rural (S. Laventure et J. M. Duplantier, unpub. data). Les recherches en cours visent à étudier les relations entre les deux espèces de rats et les deux espèces de puces dans le cycle épidémiologique de la peste à Madagascar.
La ré-émergence de la peste à Madagascar est probablement le reflet de l’effondrement général du système classique de lutte contre la peste. Le maintien prolongé de Y. pestis dans un cycle de transmission rat domestique - puce, constitue une occasion de sélection possible de caractères nouveaux capable de rendre le bacille plus virulent (pandémies historiques de peste). En réalité, trois nouveaux variants de Y. pestis ont récemment émergé à Madagascar dans les régions de Ambositra et Ambohimahasoa, foyers de peste parmi les plus actifs. Ces nouveaux ribotypes ont tendance à se propager dans de nouvelles zones géographiques sans que nous sachions pour l’instant s’ils ont acquis ou non des avantages sélectifs (5). En outre, il y a des grands risques possibles d’échange de matériel génétique avec d’autres entérobactéries. Il est possible que l’émergence à Madagascar de la première souche de Y. pestis naturellement multirésistante aux antibiotiques soit un signe important (6,7).
La peste à Mahajanga
Après deux épidémies au début du 20ème siècle à Mahajanga (150 000 habitants), la peste est restée parfaitement contrôlée entre 1928 et 1990 (2). En juillet 1991, la maladie a brutalement refait surface dans les quartiers bidonvilles près du marché au gros de Marolaka, totalisant 170 cas suspects dont 41 cas confirmés ou probables. Après trois années au cours desquelles aucun cas n’a été notifié, trois épidémies se sont succédées en juillet 1995 (8,9), juillet 1996 et juillet 1997. Les deux épidémies de 1995 et 1996 ont totalisé 1 058 cas suspects dont seulement 109 cas ont pu être confirmés et 30 cas avaient une microscopie positive. Cependant l’application d’un test sérodiagnostique (ELISA anticorps anti-F1) (4), a permis de poser le diagnostic de peste pour 93 cas supplémentaires (10). Le taux d’incidence moyen annuel a été de 77 pour 100 000 habitants. Quand à l’épidémie en cours (juillet à octobre 1997) 376 cas suspects dont 120 confirmés ont été déclarés. La peste a tendance à se propager dans d’autres quartiers de la ville.
Les épidémies ont toujours été précédées d’une importante épizootie. Pendant et après chaque épidémie, toutes les musaraignes piégées à Mahajanga étaient porteuses de nombreuses puces X. cheopis. Des recherches sont actuellement en cours pour déterminer le rôle de la musaraigne Suncus murinus dans le maintien de la peste.
La peste à Antananaviro
Since plague was introduced in the highlands in 1921, it has never disappeared from remote villages; however, in Antananarivo, it has been controlled; no human cases were reported between 1953 and 1978. In 1979, the first confirmed case was found in one of the ancient foci of the town (11). In the 1990s, a growing number of cases have been reported; 10 to 25 each year have been confirmed or are presumptive (Figure 3). In 1996, confirmed plague cases were found in 17 quarters of the capital. The mean annual rate of human cases is 1.4 per 100,000 inhabitants in 1995 and 1996.
Depuis que la peste a été introduite dans les hautes terres centrales en 1921, elle a constamment circulé dans les petits villages isolés. Cependant dans la capitale Antananarivo, elle avait été bien contrôlée puisqu’ aucun cas n’avait plus été rapporté entre 1953 et 1978. Pourtant en 1979, le premier cas confirmé ré-émergeait dans un ancien quartier reconnu de la ville (11). Dans les années 1990, un nombre croissant de cas suspects sont rapportés dont chaque année 10 à 25 malades sont des cas confirmés ou probables (Figure 3). En 1996, la peste bubonique a été confirmée dans 17 quartiers de la capitale. Le taux d’incidence annuel moyen a été de 1,4 pour 100 000 habitants en 1995 et 1996.
En 1995, sur les 625 rats piégés près de la place du marché 10% d’entre eux étaient porteurs de Y. pestis et 80 % séropositifs en anti-F1 (S. Chanteau, J. A. Drominy et B. Rasoamanana, unpub data). L’index pulicidien mensuel (le nombre moyen de X. cheopis par rat) dans ce quartier était supérieur à 4 pendant toute l’année. Un index aussi élevé représente une grave menace, d’autant que la plupart de ces puces sont résistantes à la deltaméthrine (12). Elles sont fort heureusement sensibles à d’autres familles d’insecticides comme les carbamates. Depuis 1996, le Gouvernement malgache et le Ministère de la Santé ont fait de sérieux efforts afin d’éduquer la population et le corps soignant, tout en essayant d’améliorer l’hygiène publique.
Une étude sérologique sur des rats piégés en 1997 dans huit autres quartiers de la capitale a abouti à une séroprévalence de 14 % , alors qu’elle n’était que de 4,5 % en 1965 (2) .La circulation de Y. pestis parmi les rongeurs de la capitale est donc significativement plus importante aujourd’hui.
Programme national de lutte contre la peste
Le programme national de lutte contre la peste reçoit une aide financière de la Banque Mondiale et du Ministère Français de la Coopération. Le système de surveillance épidémiologique est basé sur la notification immédiate et obligatoire de tout cas suspect de peste et sa confirmation biologique par le Laboratoire Central de la Peste. Tout cas suspect est traité par la streptomycine, et les sujets contacts par des sulfamides pour arrêter la transmission. Les insecticides sont utilisés pour la lutte anti-vectorielle contre les puces dont la sensibilité aux insecticides est surveillée. La surveillance de la sensibilité de toutes les souches de Y. pestis isolées de malade, de rats ou de puces est systématique. L’apparition de la première souche multirésistante en 1995 (6,7) et la résistance croissante des puces aux insecticides posent de sérieuses inquiétudes.
Le programme national de lutte contre la peste, mis en place à Madagascar depuis plusieurs décennies et contrecarré ces derniers temps par des difficultés économiques et opérationnelles, a besoin d’être renforcé de façon urgente.
- World Health Organization. Human plague in 1995. Wkly Epidemiol Rec 1997;46:344-8.
- Brygoo ER. Epidemiologie de la peste à Madagascar. Arch Inst Pasteur Madagascar 1966;35:7-147.
- Blanchy S, Ranaivoson G, Rakotonjanabelo A. Epidémiologie clinique de la peste à Madagascar. Arch Inst Pasteur Madagascar 1993;60:27-34.
- Rasoamanana B, Leroy F, Boisier P, Rasolomaharo M, Buchy P, Carniel E, Chanteau S. Field evaluation of an IgG anti-F1 ELISA test for the serodiagnosis of human plague in Madagascar. Clin Diagn Lab Immunol 1997;4:587-91.
- Guiyoule A, Rasoamanana B, Buchreiser C, Michel P, Chanteau S, Carniel E. Recent emergence of new variants of Yersinia pestis in Madagascar. J Clin Microbiol 1997;35:2826-33.
- Rasoamanana B, Leroy F, Raharimanana C, Chanteau S. Surveillance de la sensibilité aux antibiotiques des souches de Y. pestis à Madagascar de 1989 à 1995. Arch Inst Pasteur Madagascar 1995;62:108-10.
- Galimand M, Guiyoule A, Gerbaud G, Rasoamanana B, Chanteau S, Carniel E, Courvalin P. Multiple antibiotic resistance in Yersinia pestis mediated by a self-transferable plasmid. N Engl J Med 1997;337:677-80.
- Rasolomaharo M, Rasoamanana B, Andrianirina Z, Buchy P, Rakotoarimanana N, Chanteau S. Plague in Mahajanga, Madagascar. Lancet 1995;346:1234.
- Boisier P, Rasolomaharo M, Ranaivoson G, Rasoamanana B, Rakoto L, Andriamahefazafy B, Chanteau S. Urban epidemic of bubonic plague in Mahajanga, Madagascar. Epidemiological aspects. Trop Med Int Health 1997;5:422-7.
- Chanteau S, Rasoamanana B, Rasolomaharo M, Leroy F, Rahalison L, Buchy P, et al. Apport de la détection des anticorps anti-F1 et de l'antigénémie F1 dans l'analyse des épidémies de peste de la ville de Mahajanga. Proceedings of Colloque Scientifique de la Réunion du Conseil des Directeurs des Instituts Pasteurs et Instituts Associés; 1997; Paris.
- Coulanges P. Situation de la peste à Tananarive, de son apparition en 1921 à sa résurgence en 1979. Arch Inst Pasteur Madagascar 1989;56:9-35.
- Laventure S, Ratovonjato J, Rajaonarivelo E, Rasoamanana B, Rabarison P, Chanteau S, Roux J. Résistance aux insecticides des puces pestigènes à Madagascar et implications pour la lutte antivectorielle. Proceedings of the 5ème Congrès International de Médecine Tropicale de Langue Française; 1996; Mauritius.
Figures
Suggested citation: Chanteau S, Ratsifasoamanana L, Rasoamanana, Rahalison L, Randriambelosoa J, Roux J, et al. Plague, a Reemerging Disease in Madagascar. Emerg Infect Dis [serial on the Internet]. 1998, Mar [date cited]. Available from http://wwwnlc.cdc.gov/eid/article/4/1/98-0114.htm